 |
|
Главная :: Архив статей :: :: Ссылки |
 |
|
Главная :: Архив статей :: :: Ссылки |
Наши друзья Помощь сайту R935344738975 Наша кнопка Партнеры |
Архив статей > Химия > Опыты без взрывов > Завод в миниатюре Письма юных химиков С. Краюшкин Концентрированная азотная кислота нужна юным химикам сравнительно редко. Кстати, она и небезопасна в обращении. А разбавленный раствор HNO3, применяемый во многих опытах, можно сделать так, как предлагает семиклассник из Москвы Сережа КРАЮШКИН. Применяемая им реакция - каталитическое окисление аммиака воздухом - известна каждому школьнику: это промышленный способ получения HNO3, используемый на большинстве крупных заводов. Ну, а сережин завод - маленький, его можно устроить в школьном кружке. Вот что пишет Сережа.
Мой прибор довольно прост. Через насыщенный раствор аммиака в воде, налитый в банку 1, продувается воздух. Я пользовался для этого компрессором, но в принципе можно продувать и резиновой грушей (Внимание! Наполнять грушу воздухом можно только отсоединив ее от прибора. Воздух через раствор пропускать не слишком быстро! Опыт выполнять под тягой!) 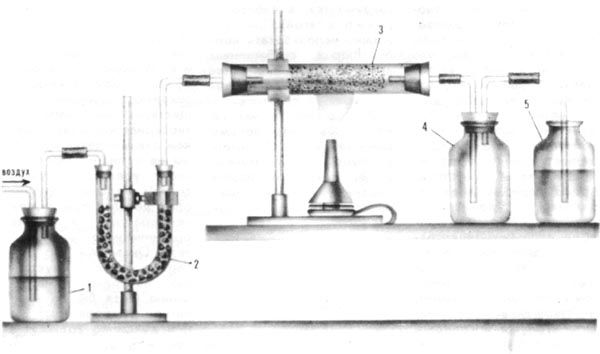 Проходя через раствор, воздух захватывает часть аммиака. Разумеется, за аммиаком потянутся и пары воды, так что после банки 1 смесь газов лучше пропустить через осушитель 2 - трубку, набитую твердой щелочью. А дальше расположен главный аппарат моего завода: трубка с катализатором 3. В качестве катализатора я брал диоксид марганца из старых батареек, который смешивал с асбестовым порошком. В аппарате 3, нагреваемом горелкой или спиртовкой, в пламя которой для повышения температуры можно тоже вдувать воздух, аммиак окисляется до смеси NO и NO2. Ну а окончательное окисление до NO2 происходит просто в пустой банке 4 - эта реакция не требует ни высокой температуры, ни нагревания, был бы только избыток кислорода, а он в такой установке есть всегда. Банка 4, кстати, полезна, чтобы раствор из следующей банки случайно не засосало в горячую трубку 3. В последней банке 5 диоксид азота поглощается водой. Тут и получается нужный многим юным химикам раствор азотной кислоты.
Главная :: Архив статей :: :: Ссылки |