 |
|
Главная :: Архив статей :: :: Ссылки |
 |
|
Главная :: Архив статей :: :: Ссылки |
Наши друзья Помощь сайту R935344738975 Наша кнопка Партнеры |
Архив статей > Химия > Опыты без взрывов > Письма юных химиков Письма юных химиков Химия и Жизнь №9, 1982 г., с. 60-65 Как всегда, письма юных химиков содержат описания разнообразных опытов. Но, разумеется, чтобы выполнить даже небольшое исследование, необходимы приборы и реактивы. С этого мы и начнем очередной обзор писем. ПРИБОРЫ И ОБОРУДОВАНИЕ Для химических опытов часто требуется дистиллированная вода. О том, как сделать высокопроизводительный дистиллятор, пишет восьмиклассник из Краснооктябрьской средней школы Владимирской области Иван САВЕНКОВ. Устройство прибора ясно из рис. 1; особо тщательно следует изготовить основной элемент - испаритель. Способ герметичного крепления кипятильника предлагаем продумать самостоятельно. Чтобы подливать воду, не вынимая пробки, в нее можно вставить третью трубку с краном или пробкой. 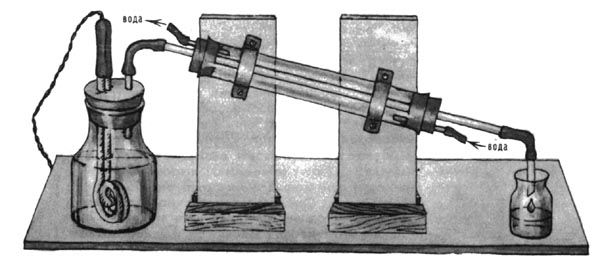 Рис. 1. Самодельный дистиллятор «Тот, кто занимался очисткой растворов, знает, как иногда мучительно долго происходит фильтрование»,- пишет москвич Игорь ПАХАРЬКОВ. Чтобы ускорить дело, прибегают к фильтрованию под давлением или с отсасыванием, используют складчатые фильтры. Игорь же предлагает усовершенствовать воронку с помощью отрезков стеклянной палочки и эпоксидного клея (рис. 2). Фильтр в такой воронке не прилегает плотно к стенке, и раствор через него проходит быстрее. 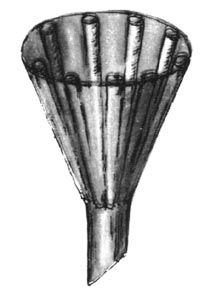 Рис. 2. Воронка для ускоренного фильтрования Чтобы получать небольшие количества газов, Леонид СТУКАН (8-й класс, школа № 77, Ленинград) использует очень простое приспособление, состоящее из двух хлоркальциевых трубок и резиновой трубки (рис. 3). Опуская или поднимая одну из трубок, можно привести прибор в действие или остановить его. Стеклянную трубку можно заменить резиновым шлангом с зажимом. 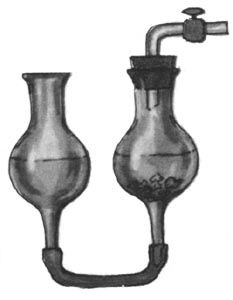 Рис. 3. Прибор для получения газов РЕАКТИВЫ На этот раз много писем посвящено электрохимическому синтезу. Чаще всего для этой цели используют угольные электроды. Однако при получении электролизом, например, серной кислоты она загрязняется продуктами разрушения угольного анода. Л. СТУКАН предлагает в этом случае заменить угольный анод на свинцовый - он практически не разрушается, и кислота получается чистой. Важная деталь электролизера - диафрагма. На страницах клуба обсуждались разные способы ее изготовления. Алексей ЖУКОВ из Ногинска Московской обл. делает диафрагму очень просто: отрезает дно от пластмассового пузырька из-под клея и заклеивает отверстие плотной тканью, с трудом пропускающей воду. В горлышко пузырька вставляется анод. Отделив таким образом анодное пространство, Алексей получил различные реактивы, например: азотную кислоту из раствора нитрата аммония (анод - железная пластинка), едкий натр и хлорид меди из раствора поваренной соли (с медным анодом) и т. д. Аналогичные эксперименты, но с другой диафрагмой (рис. 4) провел Алексей КАЛЮЖНЫЙ (8-й класс, школа № 9, Черкесск). При электролизе нитрата аммония, но с медным анодом, он получил в анодном пространстве раствор нитрата меди. Для ускорения электролиза было использовано более высокое напряжение, чем обычно применяется в таких опытах. 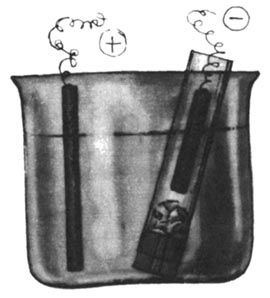 Рис. 4. Электролизер с диафрагмой (плотно свернутым комком фильтровальной бумаги) Вообще говоря, продолжительность электролиза - весьма существенный фактор в любом электрохимическом синтезе, о чем часто забывают. На это обратил внимание школьников бывший юный, а теперь профессиональный химик Александр КАМНЕВ. Прежде чем начать эксперимент, пишет он, надо прикинуть: а стоит ли овчинка выделки? Так, в № 4 «Химии и жизни» за этот год на с. 76 была опубликована заметка «Берегите цинк» - о выделении цинка из отходов. Однако расчет показывает, что при рекомендуемой плотности тока и площади катода 6 см2 за 2 часа выделится всего 0,14 г цинка. Оцинковать катод таким способом можно, а вот применить полученный металл снова... Так что с помощью электролиза в домашних условиях можно получать лишь очень небольшие количества веществ. Многие школьники знают, что источником некоторых реактивов могут служить пигменты - основа масляных красок. Пятиклассник Андрей БОРОДЬКО из Черноголовки (Московская обл.), шестиклассник Алексей ЛЯХОВИЧ из Новосибирска и другие ребята напоминают, что цинковые белила содержат ZnO, свинцовые - 2РbСO3∙Рb(ОН)2, титановые - ТiO2, литопон - ZnS и BaSO4, бланфикс - BaSO4, кадмий желтый - CdS, стронциановая - SrCrO4, кобальтовые краски - фосфат или оксид кобальта и т. д. Нерастворимые в воде хроматы и сульфаты щелочноземельных металлов можно перевести в растворимые соли по схеме MeSO4 + Na2CO3 ↔ MeCO3 + Na2SO4; MeCO3 + 2HCl → MeCl2 + H2O + CO2. Если Ме = Са (гипс), первая стадия идет легко - равновесие почти полностью сдвинуто вправо. Но уже для Me = Sr необходимо кипятить сульфат с избытком соды. Если же взять реагенты в соответствии с уравнением реакции, то выход SrCO3 составит лишь 67%; это установил девятиклассник из Воркуты Юра МАКАРЫЧЕВ. В прошлых обзорах был затронут вопрос о получении бария из бумаги. Д. ШУМАКОВ из Запорожья провел настоящий «следственный эксперимент» с листом плотной белой бумаги. После ее сжигания, прокаливания золы, промывания серной кислотой и щелочью осталась почти белая масса - наполнитель. Из нее удалось получить немного вещества, которое окрашивало пламя в желто-зеленый цвет, что характерно для солей бария. Так можно обнаружить барий в некоторых сортах бумаги, но реактива из нее, очевидно, не получить. Некоторые школьники предлагают получать кислоты, сливая хлориды, нитраты и сульфаты кальция, магния, цинка со щавелевой кислотой. Однако чистая кислота не получится, так как оксалаты всех щелочноземельных и многих других металлов довольно хорошо растворимы в кислотах. Поэтому равновесия типа Me(NO3)2 + Н2С2O4 ↔ МеС2O4 + 2HNO3 будут в значительной степени смещены влево. В январском выпуске клуба был описан очень простой способ выделения серебра из отработанного фиксажа с помощью медной фольги. Однако, как сообщил А. ЛЯХОВИЧ, таким образом серебро извлекается далеко не полностью, поэтому надо либо кипятить раствор, либо использовать более сильный восстановитель, например раствор проявителя. Один из наиболее употребительных реактивов - едкая щелочь. Для получения ее из раствора можно использовать давно известный, но редко применяемый способ - взаимодействие гашеной извести с раствором соды или поташа: Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH. Этот метод применяет с успехом москвич В. ЕГОРОВ. Он же предлагает юным химикам для получения соединений олова брать не чистый металл, который трудно достать, а обычный третник, используемый для пайки. Если его расплавить и долго прокаливать на воздухе, он превратится в смесь оксидов - РbО и SnO2. Для разделения металлов эту смесь надо растворить в горячем 10%-ном растворе щелочи (работать осторожно!) и добавить 3%-ную перекись водорода. В результате реакции PbO + 4NaOH → Na4[Pb(OH)6] —(Н2О2)→ РbO2↓ + 4NaOH + 2H2O свинец выпадет в осадок, а в растворе останется Na2SnO3, из которого можно получить и другие соединения олова. Немного о получении органических веществ. Для некоторых опытов нужен чистый глицерин, который не всегда можно купить. В. ЕГОРОВ предлагает выделить его из раствора Люголя (94% глицерина, 3% воды, 1 % 12 и 2% KI). Иод и иодид калия экстрагируются несколько раз небольшими порциями ацетона до обесцвечивания глицерина. Для полного удаления из него воды и ацетона глицерин надо нагреть до 100°С. Из ацетонового раствора можно выделить йод (как из йодной настойки), а можно смешать его с водным раствором щелочи или соды и нагреть - выпадет желтоватый осадок йодоформа с характерным запахом. Это - прекрасный антисептик, широко применявшийся ранее в хирургии. Механизм реакции таков. Сначала в молекуле ацетона водород замещается на йод: СН3-СО-СН3 + 3I2 → Сl3-СО-СН3 + 3HI, а затем это соединение расщепляется щелочью: Cl3-СО-СН3 + NaOH → CHI3 + CH3COONa. Два распространенных органических растворителя - этилацетат и хлороформ получил Михаил РОДЫГИН (10-й класс, школа № 4, Горловка). Он тоже не прибегал к сложному органическому синтезу, а извлек растворители из продажных препаратов. Этилацетат - из средства для мытья стекол «БЛО» (оно содержит кроме эцилацетата воду и аммиакат меди). Сначала аммиак нейтрализуют серной кислотой, а затем перегоняют смесь. Для ее осушки (этилацетат образует с водой азеотроп, содержащий 8,5% воды и кипящий при 70,4°С) следует сначала отогнать мутный азеотроп, а затем чистый растворитель (т. кип. 77°С) или же использовать после перегонки осушитель - безводный CaCl2, CuSO4 и т. п. Небольшое количество хлороформа (~ 50 мл) можно выделить из пасты Розенталя (80% хлороформа, 10% спирта, 8% парафина и 2% иода). Сначала из смеси отгоняют йод с хлороформом, затем удаляют йод водным раствором тиосульфата и очищают хлороформ от воды так же, как этилацетат. ИССЛЕДОВАНИЯ Интерес юных химиков вызвал поиск элементов, соединения которых могут быть окрашены во все цвета радуги. Ранее в клубе были описаны такие соединения ванадия, молибдена, хрома, меди. Теперь Евгений ШАДАЙ (7-й класс, школа № 621, Москва) сообщает о том же свойстве соединений железа (включая его комплексные соли). Это показывает, что, вероятно, все металлы переменной валентности могут давать соединения самых разнообразных расцветок. Более полезным для практических целей может оказаться эксперимент А. ЛЯХОВИЧА. Он приготовил разноцветные лаки из пластмассовых школьных закладок. Их надо мелко нарезать и залить ацетоном. На следующий день получится красивый цветной лак, которым можно не только окрасить разные поделки, но и рисовать на бумаге, так как лак быстро высыхает. Держать лак и окрашенные им предметы следует подальше от огня. С цветными превращениями связаны и опыты с индикаторами. Алексей ГИЗАТУЛЛИН (8-й класс, школа № 851, Москва) сообщает, что смесь CuSO4 и К2Сr2O7 при добавлении щелочи становится зеленой, а в присутствии кислоты снова желтеет. Москвич Григорий СЕРЕДА также сделал свой индикатор, нагревая 2 мл глицерина с небольшим количеством (NH4)2Cr2O7 с последующим добавлением спирта. После фильтрования получился ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде восстанавливает зеленый цвет. А Эдвард МЕЛЬНИКОВ (9-й класс, школа № 2, гор. Цесис Латв. ССР) не стал изобретать новые индикаторы, а взял всем известный фенолфталеин и сделал из него два раствора - нейтральный и слабощелочной. Теперь две капли этих растворов надо по отдельности смешать с двумя каплями исследуемой жидкости: если испытуемый раствор кислый, перед нами будут две бесцветные капли, если щелочной - две красные, а если нейтральный, то будет одна красная и одна бесцветная капли. Константин БОЯНДИН (8-й класс, школа № 27, Семипалатинск) провел несколько опытов с окислителями. Пропуская хлор в ледяной раствор щелочи, он получил гипохлорит натрия, с помощью которого соль железа (III) в среде концентрированной щелочи была окислена до феррата K2FeO4. Второй окислитель Константин сделал из обычной перекиси водорода. Ее окислительную силу можно увеличить, добавив перед самой реакцией соль железа (II). Такой раствор называется реактивом Фентона. Его силу можно проверить на 1%-ном растворе KI: бурая окраска йода появляется значительно быстрее, чем при окислении только перекисью. Очень интересные опыты провел К. БОЯНДИН по окислению различных металлов диоксидом азота. Наиболее активные щелочные и щелочноземельные металлы в среде NO2 покрывались оксидной пленкой, а при нагревании энергично окислялись (амальгамированный алюминий даже вспыхнул). Такие металлы, как железо, никель, олово окислялись незначительно. А вот губчатая медь даже при обычной температуре энергично присоединяла NO2, образуя красно-бурый порошок. Под действием воды он бурно разлагался с выделением бесцветного газа, буреющего на воздухе (NO), а в колбе оставался оксид, аммиачный раствор которого дает с ацетиленом темно-бурый осадок, то есгь этот оксид - Cu2O. К. БОЯНДИН предположил, что образующееся вначале вещество - это соединение состава Cu2NO2. Интересно, что точно к такому же выводу пришли в 1896 г. французские химики Сабатье и Сендеренс; образовавшийся коричневый осадок они назвали нитроксилом меди. Однако последующие исследования этот вывод не подтвердили: оказывается, сначала идет реакция 2Cu + NO2 = Cu2O + NO, а затем оксиды азота адсорбируются оксидом меди (I), причем в значительном количестве - до 33% по массе. Получается стабильный в сухом воздухе порошок, который при нагревании в замкнутом объеме отщепляет NO2, оставляя Cu2O, а при охлаждении NO2 вновь поглощается. Аналогичные «адсорбционные комплексы» дают и другие металлы. Например, были получены соединения состава Fe2NO2, Co2NO2 и Ni4NO2 При сильном нагреве (до 250°С) реакция идет иначе - образуются СuО и N2. Михаил ГИЛЯРОВ (школа № 224, Москва) предлагает юным химикам провести опыт, описанный в старой и потому малодоступной книге В. В. Рюмина «Занимательная химия» (она издана в 1936 г.). В пробирку вставляют картонный кружок, через который проходит медная проволока (рис. 5). Нижняя ее часть доходит почти до дна, а верхняя припаяна к цинковому кольцу. Вся верхняя часть проволоки должна быть изолирована (водостойким клеем, сургучом и т. п.). В нижнюю часть пробирки наливают насыщенный раствор SnCl2, а сверху - насыщенный раствор NaCl. Через некоторое время у перегородки вырастают кристаллы металлического олова.  Рис. 5. Прибор для получения кристаллов олова Алексей КОЧЕТОВ (он учится вместе с А. Калюжным) провел опыты по измерению электропроводности растворов электролитов разной концентрации. Идея была такая: если электроды жестко закреплены, а напряжение постоянно и невелико (~ 1 В), то в принципе можно определить концентрацию вещества по величине тока, построив предварительно калибровочный график для данного вещества. Опыты показали, что если ток постоянный, его величина непрерывно падает со временем, поэтому измерения надо проводить на переменном токе; в этом случае в течение по крайней мере 10-20 с ток почти не меняется. А. КОЧЕТОВ напоминает также школьникам, которые ходят в походы, что существует простой способ оценки чистоты воды в реке, озере и т. п. Для этого надо влить в воду слабый раствор перманганата калия и немного подождать. Если раствор обесцветился, значит в воде есть органические примеси, что указывает на возможное присутствие и болезнетворных микробов. Такую воду можно пить только прокипяченной. О «ФАНТАСТИЧЕСКИХ» ОПЫТАХ И ПЛАГИАТЕ Этот раздел мы советуем внимательно прочитать всем школьникам, которые присылают в редакцию результаты своих экспериментов. Основное внимание, как правило, уделяется тем письмам, в которых описаны самостоятельно проведенные опыты. Дело в том, что взять вузовский учебник или другую книгу по химии и выписать оттуда несколько опытов может каждый. Совсем другое дело - поставить опыт самостоятельно и честно описать его и все встретившиеся трудности. Так будут исключены и грубые ошибки. Например, поступали предложения получать натрий электролизом расплава его соли - тиосульфата натрия (т. пл. 48,5°С), йодистый водород - нагреванием KI с концентрированной серной кислотой, барий - электролизом расплава нитрата бария и т. п. Если попытаться провести такие опыты, сразу станет ясна их нереальность: при нагревании тиосульфат растворяется в собственной кристаллизационной воде, то есть это фактически не расплав, а водный раствор, из которого натрий, естественно, не выделишь; серная кислота при нагревании попросту окислит KI (а тем более HI) до йода; расплав селитры - сильный окислитель, в котором сгорает не только барий, но даже молибден. Особо следует остановиться на таких недопустимых фактах, как списывание опытов без указания источника. В качестве примера можно привести письмо от школьника X. с описанием ряда интересных опытов. К его счастью, у одного из сотрудников редакции оказалась хорошая память и он довольно быстро нашел оригинал-статью, опубликованную в одном из первых номеров «Химии и жизни» в 1965 г. Сравнение статьи с письмом показало, что опыт переписан дословно, практически без изменений и без ссылки на первоисточник, то есть фактически выдан за свой собственный. А повезло X. вот почему. Если бы сотрудники редакции ничего не заметили (что вполне возможно, так как прошло много лет), то письмо могло быть опубликовано. Тут-то и начались бы неприятности! Читают журнал сотни тысяч человек, поэтому плагиат (а именно так называется выдача чужого произведения за свое) обнаруживается практически всегда и идут в редакцию одно за другим сердитые письма. Приходится редакции на страницах журнала приносить извинения читателям и указывать настоящего автора (такие случаи, к сожалению, бывали). А «прославиться» на всю страну таким образом - вещь очень неприятная. Все сказанное выше вовсе не означает, что опубликованные где-то опыты нельзя использовать снова. Так, в 1978 г. в издательстве «Химия» вышла книга «Опыты без взрывов», составленная О. Ольгиным и целиком основанная на публикациях в «Химии и жизни» за много лет. Но в книге об этом прямо сказано на с. 2, а на с. 7 перечислены авторы опытов... Поэтому в письмах следует указывать, взяты ли опыты из какой-либо книги или журнала, или описаны по аналогии с известными опытами, или полностью придуманы самостоятельно. И обязательно надо указать, проверены ли они экспериментально или это предлагается сделать другим школьникам, имеющим больше возможностей для проведения опытов.
Главная :: Архив статей :: :: Ссылки |